Géochimie organique
Contacts :
► Catherine Lorgeoux, responsable technique
Tél. +33 (0)3 72 74 55 28
► Raymond Michels, responsable scientifique
Tél. +33 (0)3 72 74 55 61
La plateforme en video
L'objectif de la plateforme géochimie organique est de caractériser et d'analyser les composés organiques dans les matrices solides et liquides comme les roches, les sols, l'eau ou les gaz en contexte géologique et environnemental. Le savoir-faire et les connaissances acquis sur la matière organique, nous ont permis d'être parmi les premiers à simuler au laboratoire les différentes étapes de formation du pétrole et des gaz.
Le principe
Nous isolons la matière organique, identifions ses constituants moléculaires et les quantifions grâce à un savoir-faire unique qui s’appuie sur un parc analytique très complet se basant sur les techniques d’extraction, de thermodésorption, de pyrolyse, de chromatographie et de spectrométrie de masse. L’ensemble des données obtenues permet d’identifier les sources des produits organiques, de caractériser leur mode de transfert, leurs interactions avec le milieu et de tester leur caractère inerte ou réactif.
Nous avons pour particularité d’adapter les protocoles et les outils aux objectifs spécifiques d’une question scientifique. Nous interagissons avec les demandeurs afin de développer les stratégies expérimentale et analytique nécessaires. Pour cela nous pouvons créer des couplages instrumentaux innovants et originaux.
Ces dispositifs et développements sont accessibles après échange avec les responsables de la plateforme et définition de vos besoins.
Ainsi nous pourrons caractériser les matières hydrocarbonées complexes des sols et du sous-sol afin de vous assister dans vos études géologiques ou environnementales.
Le laboratoire de Géochimie Organique est dédié à l’analyse des matrices solides (roches mères, sols, sédiments…), liquides (pétrole, eaux…) mais aussi gazeuses. Ces échantillons peuvent être issus de prélèvement in situ, d’expérimentation au laboratoire (oxydation, biodégradation, lessivage…) ou sur la plateforme d’expérimentation (maturation artificielle : capsules en or, réaction en conditions contrôlées de température, de pression : autoclaves….).
Afin d’étudier la Matière Organique et sa réactivité dans plusieurs contextes, le laboratoire dispose de plusieurs appareils nécessaires à la préparation de ces divers échantillons en vue de leur analyse :
Extraction accélérée sous solvant : ASE 350 (Dionex) [A], extraction au soxhlet [B] :
Extraction SPE (Solid Phase Extraction) manuelle dédiée à l’extraction de grands volumes d’eau [A] et système automatisé ASPEC (Gilson) [B] pour la purification des extraits :
Extraction SPE (Solid Phase Extraction) manuelle dédiée à l’extraction de grands volumes d’eau [A] et système automatisé ASPEC (Gilson) [B] pour la purification des extraits :
Ces différents outils sont utilisés pour extraire la Matière Organique, mais peuvent aussi, en utilisant des plans d’expérience soigneusement préparés, permettre l’étude de sa réactivité et de son rôle au sein de systèmes simplifiés (évolution dans le temps, oxydation, lessivage…) en vue d’améliorer la compréhension de systèmes réels.
L’ensemble des outils présents au laboratoire permettent d’effectuer des analyses qualitatives mais aussi quantitatives des composés organiques présents dans ces matrices.
Plusieurs outils disponibles au laboratoire permettent la caractérisation des extraits obtenus ou des échantillons :
Spectromètre UV/Vis : (Thermo Fisher Scientific)
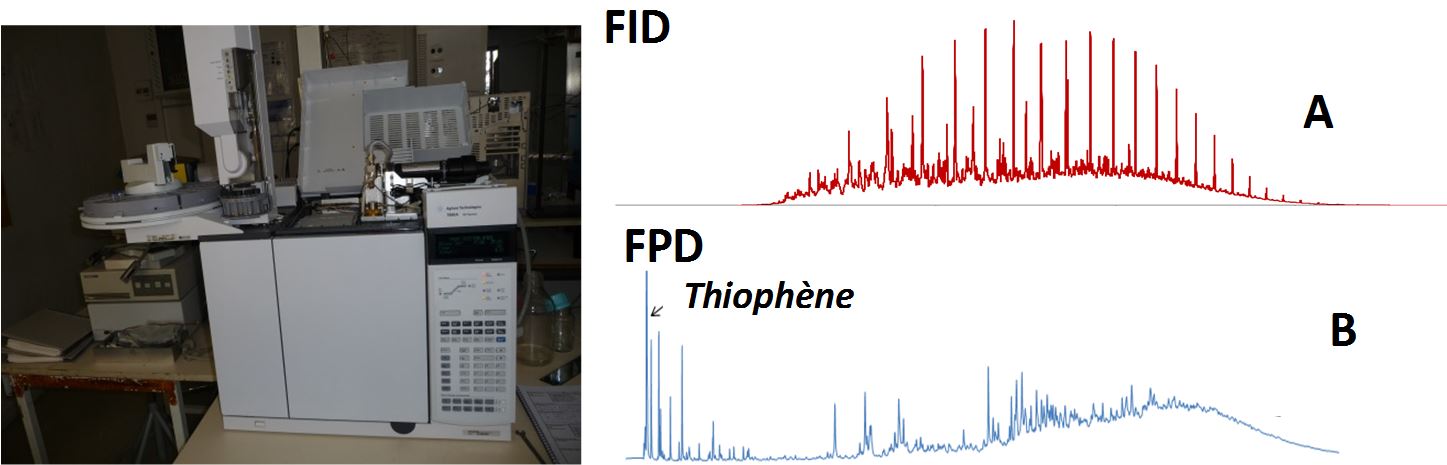
GC/FID-FPD (Agilent) : chromatographie gazeuse (GC) couplée à un détecteur à ionisation de flamme (FID) pour l’analyse des hydrocarbures et à un détecteur à photométrie de flamme (FPD) dédié à la détection des composés soufrés.
[A] Chromatogramme correspondant à un gasoil obtenu en FID
[B] Chromatogramme d’un pétrole soufré obtenu en FPD
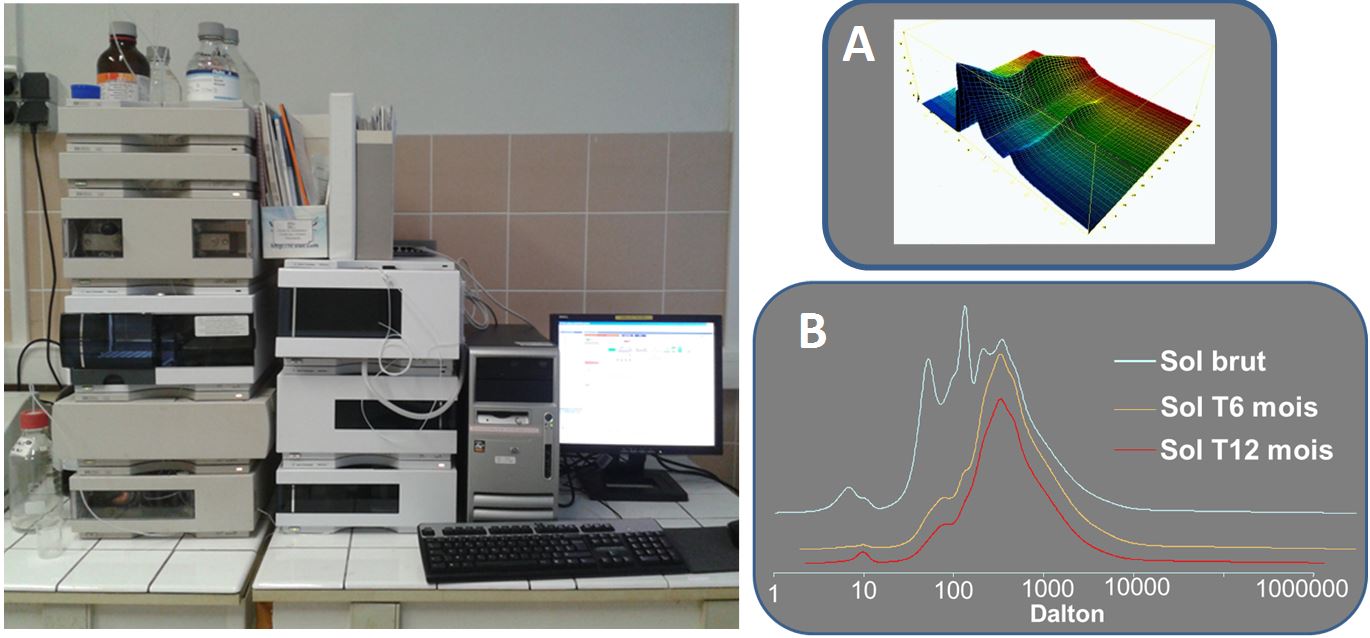
HPLC/DAD-Fluo-RID (Agilent) :
chromatographie liquide (HPLC) fonctionnant principalement avec une colonne d’exclusion stérique (GPC) couplée à un détecteur barrette de diodes (DAD), à un détecteur fluorimétrique (Fluo) et à un réfractomètre (RID). Ce couplage est dédié à l’analyse de la distribution moléculaire dans les eaux et dans les extraits organiques.
[A] HPLC/SEC Fluo : Distribution des fluorophores dans une eau de piézomètre
[B] HPLC/GPC DAD : Répartition des masses moléculaires dans un extrait : étude de biodégradation sur un sol pollué
- Des outils complémentaires permettent une caractérisation moléculaire et la quantification de composés ciblés :
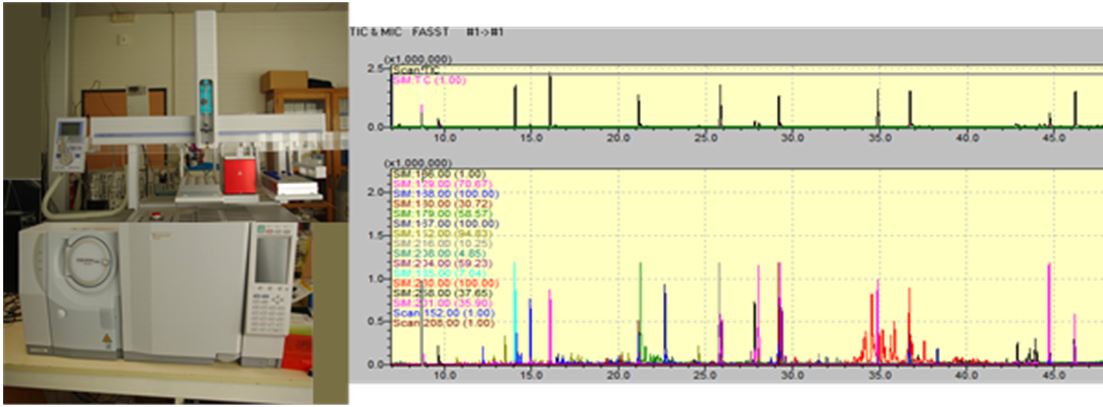
GC/MS (Agilent et Shimadzu) : 3 appareils de chromatographie gazeuse (GC) couplée à un spectromètre de masse (MS) composé d’une source d’ionisation par impact électronique et d’un analyseur quadripôlaire.
Un des appareils est équipé d’un AOC-5000 (Shimadzu) permettant de faire de l’injection liquide, gazeuse ou par fibres SPME (Solid Phase MicroExtraction).
Les colonnes chromatographiques utilisées sont choisies en fonction de l’étude (identification large, composés polaires, soufrés…).
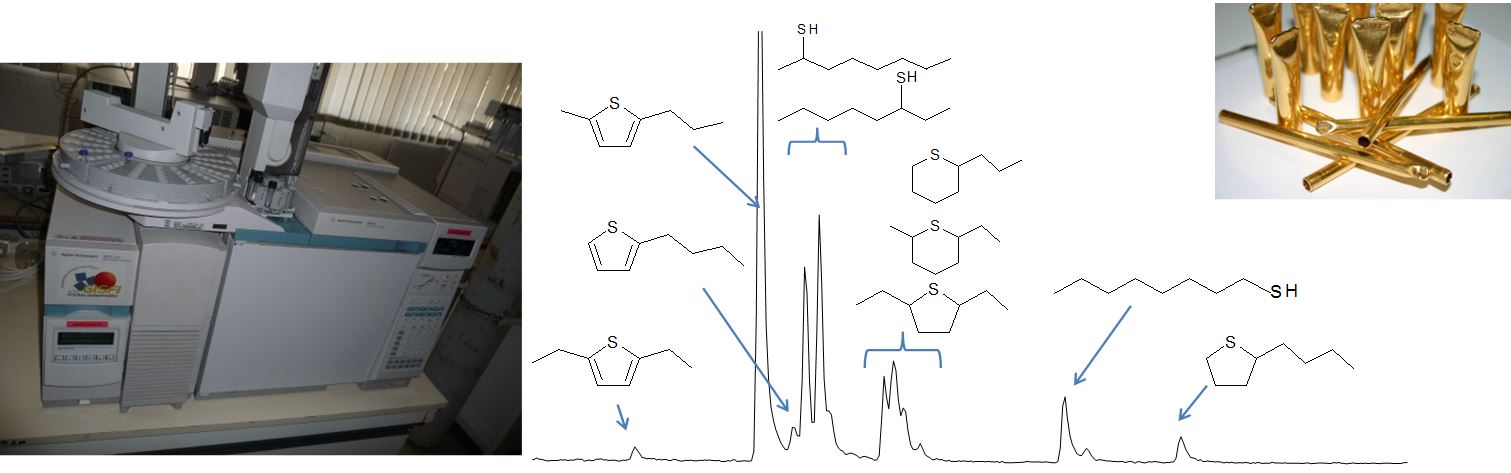
Pyrolyse en capsule en or du n-octane en présence de H2S : identification des composés en GC/MS
Injection d’un extrait de sol issu d’une friche industrielle : quantification des Composés Aromatiques Polycycliques en GC/MS
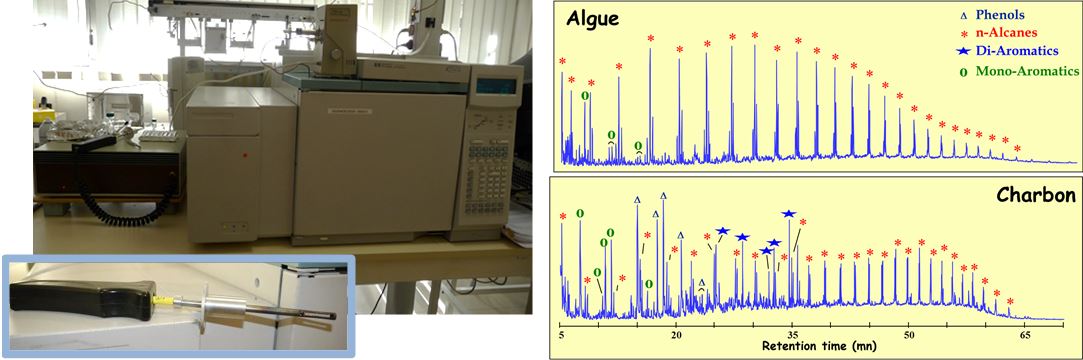
Py/GC/MS : couplage de la pyrolyse flash (CDS) à la GC/MS (Agilent) permettant d’obtenir des signatures avec identification des molécules à partir des échantillons solides : échantillon de départ ou résidu après extraction au solvant (appelé non extractible).
Différence de signatures entre Matière Organique aquatique (Algue) et terrestre (Charbon) obtenue par Pyrolyse Flash de résidus non extractibles au solvant.
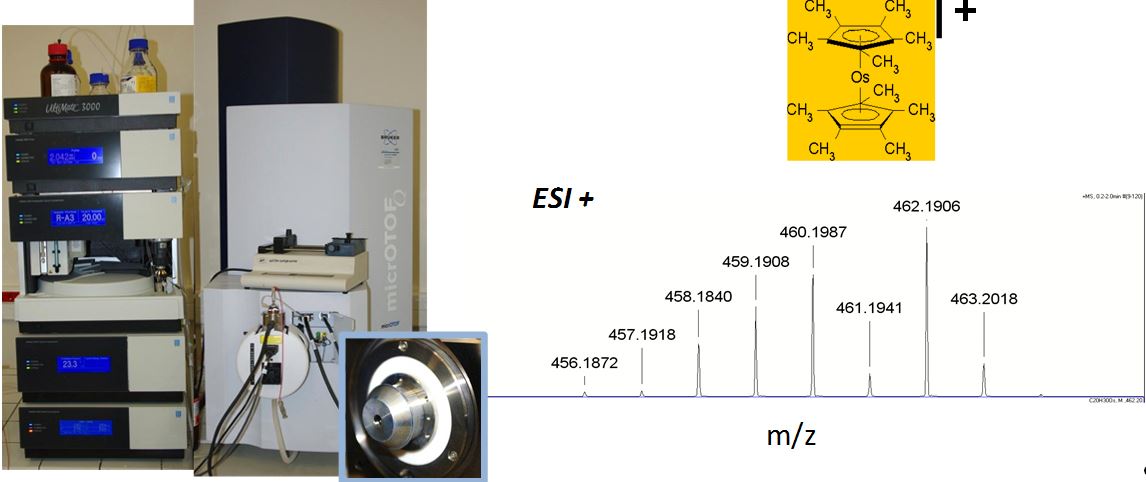
HPLC/DAD-QTOF (Dionex/Bruker) : chromatographie liquide (HPLC) couplée à un détecteur barrette de diode (DAD) et à un spectromètre de masse composé d’un analyseur quadripôle (Q) et d’un analyseur à temps de vol (TOF). Le laboratoire est équipé de 3 sources d’ionisation : ESI (Electrospray), APCI (Atmospheric Pressure Chemical Ionization) et APPI (Atmospheric Pressure PhotoIonization).
Ce couplage permet d’analyser des molécules moyennement polaires à très polaires et de hauts poids moléculaires avec une grande résolution en masse.
Spectre de masse obtenu après infusion directe dans la source électrospray en mode positif (ESI+)
d’un complexe organo-métallique dilué dans un mélange Méthanol/Dichlorométhane
- Des couplages plus spécifiques sont développés par les chercheurs et ingénieurs de l’équipe afin d’approfondir certaines thématiques :
Thermodésorption /GC/TCD et thermodésorption/MDGC/FID-TCD
Le premier couplage (Agilent) permet l’analyse des gaz légers comme l’argon, l’azote, le dioxyde de carbone, l’hydrogène….
Le deuxième couplage permet de gagner en résolution grâce à la MultiDimension (Shimadzu) et d’analyser dans une même injection les gaz légers avec le catharomètre et les hydrocarbures de C1 à C20 avec le détecteur à ionisation de flamme (FID). Les gaz légers sont séparés des hydrocarbures dans le premier appareil de chromatographie gazeuse (GC) puis envoyés dans le deuxième GC pour une séparation plus fine et une détection par catharomètre (TCD).
Les gaz analysés sont générés lors de réactions en milieu contrôlé réalisées sur la plateforme d’expérimentation . Le four de thermodésorption permet de travail à différentes températures de l’ambiante à 300°C et d’analyser les gaz issus de capacités (prélèvement des autoclaves) ou après perçage des capsules en or (maturation artificielle).
Py-Td/GC/MS-FID : four de pyrolyse/thermodésorption (Frontier Lab) couplé à un GC/MS-FID (Agilent).
Ce couplage permet d’identifier et de quantifier les produits organiques désorbés au cours d'un programme de température. Trois modes d'analyse sont possibles :
- Le mode EGA (Evolved Gas Analysis) : utilisation du four de thermodésorption avec chauffe progressive de l’échantillon et analyse directe en MS et FID (colonne inerte, sans film) avec suivi des profils d’ions caractéristiques au cours de la chauffe.
- Le mode pyrolyse flash : pyrolyse à une température donnée avec analyse GC/MS-FID classique.
- Le mode thermodésorption (Td) avec piège cryogénique : utilisation de la rampe de chauffe programmable avec piégeage cryo en tête de colonne afin de concentrer les composés libérés, puis analyse de ces composés par GC/MS-FID.
Ce couplage permet d’étudier les interactions entre les composés organiques et la matrice solide (minéraux, sols, sédiments, roche mère ou autre).

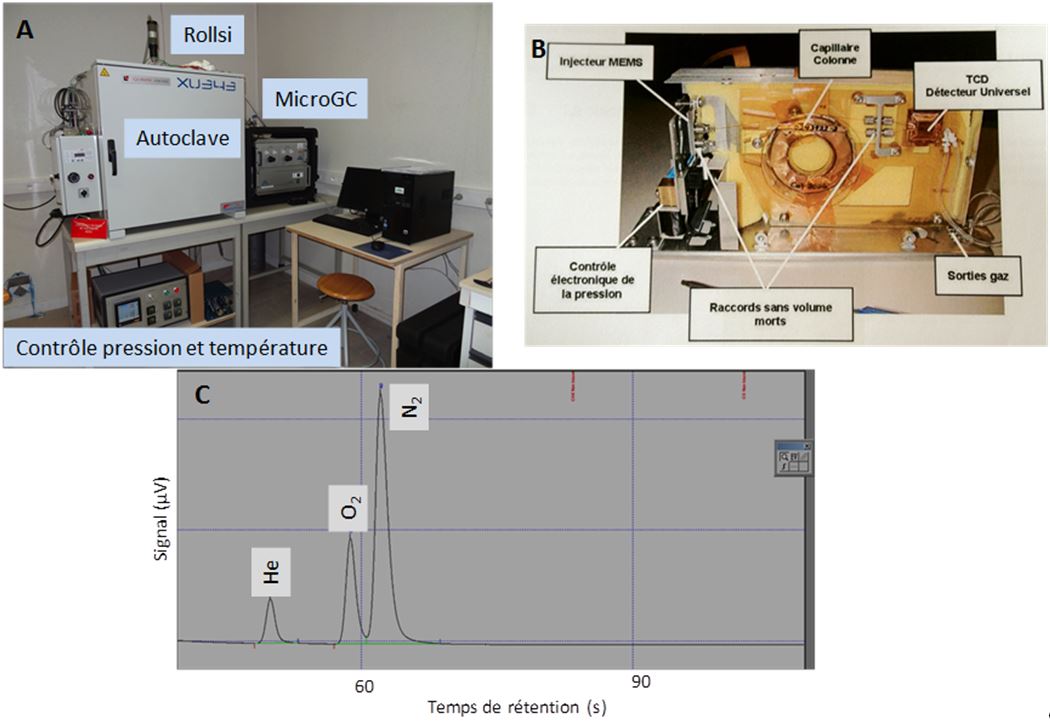
Autoclave/microGC : couplage effectué grâce à une vanne Rolsi® qui permet de prélever des micro-échantillons de gaz sans perturber la pression dans l’autoclave et de suivre ainsi une cinétique de réaction à pas de temps très courts. Des analyses de 2 min sur le microGC (SRA R3000) permettent, grâce à 3 modules d’analyses, de quantifier les gaz légers et les hydrocarbures de C1à C8.
[A] Couplage autoclave/microGC
[B] Vue éclatée d’un module du µGC
[C] Exemple de chromatogramme obtenu sur le module A (tamis moléculaire)